国家药监局(2021年9月17日)发布的《关于做好第二批实施医疗器械唯一标识工作的公告》中,明确将所有第三类医疗器械(含体外诊断试剂)纳入第二批实施唯一标识范围并规定了2022年6月1日完成的时间节点。
即在国家局的层面上,要求全国所有三类医疗器械在今年6月1日前,必须全部完成UDI实施。同时,这也意味着距离全国一类和二类医疗器械的实施也更进了一步。
医疗器械等级
医疗器械范围广泛,通常是指用于治疗或诊断,与病人直接接触的仪器或设备。无论是一副简单的隐形眼镜,还是心脏起搏器等更复杂的设备,我们在日常生活中使用到医疗器械的频率非常高。
三类医疗器械—高风险
包括可植入心脏起搏器、脉冲发生器、艾滋病毒诊断测试、自动体外除颤器,内源性植入物,长时间佩戴的隐形眼镜等。
二类医疗器械—中等风险
包括针灸针、日常佩戴的隐形眼镜、电动轮椅、输液泵、手术用布帘和用于患者识别和健康信息的可植入射频应答器系统等。
一类医疗器械—低风险
包括弹性绷带、检查手套和手持手术器械等。
时间点
医疗器械企业根据产品所属的类型规划其合规流程。类别不同,UDI法规控制强度也不同,等级越高,控制越强,相应的合规时限也越早。第三类医疗器械的完成时限早于其他两类。
UDI是什么?
“医疗器械唯一标识,是指在医疗器械产品或者包装上附载的,由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别。”(《医疗器械唯一标识系统规则》第三条)“医疗器械唯一标识包括产品标识和生产标识。”(《医疗器械唯一标识系统规则》第七条)
医疗器械唯一标识系统(UDI System)是当前医疗器械监管领域的热点。美国和欧盟委员会先后于2013年和2017年发布UDI系统相关法规,中国也于2019年8月发布《医疗器械唯一标识系统规则》,旨在建立一个医疗器械全生命周期的充分识别体系。
GS1标准下的UDI标识规范
根据医疗器械的使用风险等级及追溯要求,UDI代码结构由DI(器械标识静态信息)和PI(生产标识动态信息)组成。基于GS1标准的UDI编制结构,范例如下图:
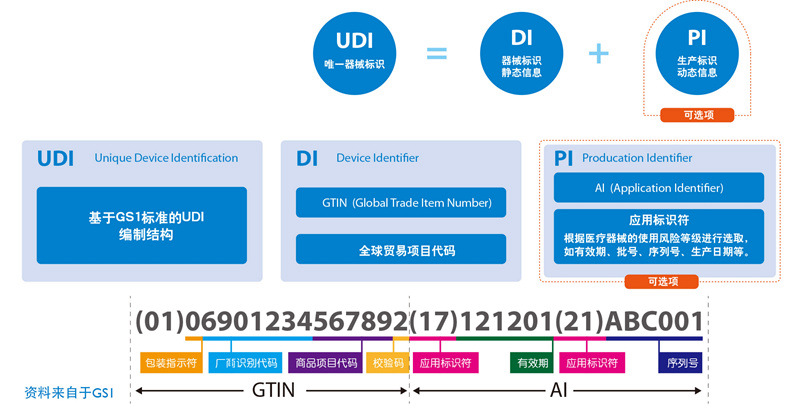
由于医疗器械使用风险和监管追溯要求的不同,UDI的编制也随之变化。UDI可由DI单独表示,也可由DI加PI联合使用表示。
医疗器械唯一标识数据库显示,截至2022年2月15日,我国采用GS1标准的DI有1074741条,占比91%。
多米诺为GS1战略合作伙伴
为何实施UDI
应用UDI可以提高召回程序的效率,减少医疗事故,增加库存可见性和供应链安全性。
在制造阶段应用于每个产品的UDI将为供应链管理系统提供关键信息,比如产品是什么,生产地点和时间,现在的位置以及流转路径。在产品出现故障而需要召回的情况下,UDI对于监管链至关重要,可以追溯源头。
UDI的实施流程
多米诺解决方案
多米诺的每台设备都配备统一的操作系统及编辑界面,强大的外部数据通讯功能,通过多米诺赋码软件,将每个产品和包装级别创建的全球通用的GS1系统中的GTIN编码进行智能分配和编辑,同时与企业采用的ERP等管理系统的无缝集成,使得各分厂或不同产线通过系统获知包含GTIN的订单信息后,凭借多米诺各级包装UDI标识解决方案,在产品和级包装上精确配对、并打印,包括GTIN和产品数据(批号,有效期等),以及自动生成的一维条码、二维码;其后构成后续环节——识别系统,将数据自动识别,并上传至医疗器械唯一标识数据库,各平台实现数据共享。
医疗器械产品的包装材料众多,从一级包装包括金属手术刀、医用透析纸(特卫强)、软袋、纸盒等材料,二/三级包装包括外箱(瓦楞箱)等材料,多米诺结合自身经验,根据不同的包装材质及产品特点,提供全面的产品序列化解决方案,满足各种包装赋码要求。
企业选择合适的赋码标识系统,需要考虑多个方面,如材料、产量、数据管理等。更重要的是,企业需要尽可能有效地管理他们的时间表,并且有足够的时间来测试解决方案,对新的赋码要求做出必要的调整。
提前做好准备,并与可靠的供应商和合作伙伴合作,可以确保在截止日期前做到合规。